Druck
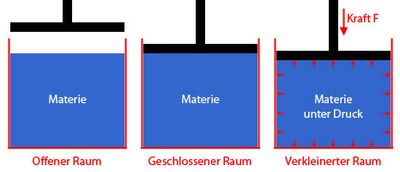
Befindet in einem geschlossenen Raum Materie (z.B. Flüssigkeit oder Gas) und wird versucht, den Raum zu verkleinern, setzt die Materie gegen die Verkleinerung des Raums Widerstand entgegen. Dieselbe Wirkung tritt auch auf, wenn der geschlossene Raum zwar nicht verkleinert wird, dafür mehr Materie in den Raum zugeführt wird. Der Widerstand bewirkt, dass an den Wandflächen des Raums eine Kraft ausgeübt wird, das Druck genannt wird. Die physikalischen Größen Druck und Kraft werden dahingehend unterschieden, dass die Kraft angibt, wie stark ein Körper auf einen anderen Körper einwirkt und Druck dagegen die Kraft auf eine Fläche angibt.
Einheit Pascal (Pa) und bar
Die Einheit für Druck ist Pascal (Pa). 1 Pascal beschreibt die Krafteinwirkung von 1 Newton auf 1 m². Druck wird auch häufig in bar angegeben. 1 bar entspricht der Krafteinwirkung von 100.000 Pascal bzw. 10 Newton auf 1 cm². Mit der Einheit Pascal wird Druck genauer angegeben. Pascal eignet sich daher bei geringen Druckkräften. Die Einheit bar eignet sich bei großen Druckkräften.
Veränderung von Volumen und Dichte der Materie
Theoretisch lässt sich jede Materie unter Druck komprimieren. Dabei verringert sich das Volumen und die Dichte wird erhöht. Im Gegensatz zu Gasen gelten Feststoffe und Flüssigkeiten jedoch als nicht komprimierbar, da für die Komprimierung enorme Kräfte notwendig wären, die es in der Praxis kaum gibt. Als komprimierbar gilt nur Materie, dessen Dichte bei einer Druckveränderung spürbar geändert wird. Das ist nur bei Gasen der Fall.
Schweredruck
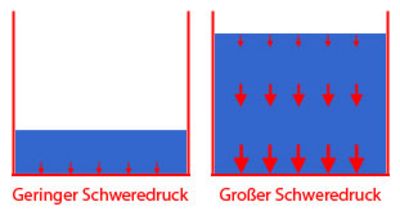
Auch in ungeschlossenen Räumen entsteht Druck, der durch das Eigengewicht der Materie entsteht und Schweredruck genannt wird. Dabei wirken die Gewichte der oberen Schichten auf die unteren Schichten und bei zunehmender Tiefe lasten immer höhere Kräfte, so dass der Druck dabei zunimmt. Das macht sich z.B. in der Luft bemerkbar. Luft hat, wenn auch ein geringes, Eigengewicht. Je höher man steigt, umso "dünner" wird die Luft. Auf der Erdoberfläche ist die Luft dagegen "dicker", da die oberen Luftschichten mit ihrem Gewicht darauf lasten. Auch in den Ozeanen ist zu beobachten, dass der Druck größer wird, je tiefer man eintaucht. Dabei lasten die Gewichte der Wassermassen auf die jeweils darunter liegenden Schichten und sorgen so für den Schweredruck.
Druck und Schweredruck berechnen
Folgende Formelzeichen werden bei Druckberechnungen verwendet:
- Druck: Formelzeichen p
- Kraft: Formelzeichen F
- Fläche: Formelzeichen A
- Fallbeschleunigung (9,81 m/s²): Formelzeichen g
- Dichte der Materie: Formelzeichen ϱ
- Tiefe: Formelzeichen h
Formel für Druck und Schweredruck
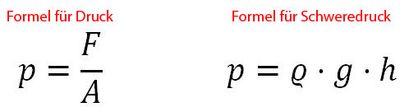
Beispielberechnung für Druck:
Kraft (F): 50000 Newton
Fläche (A): 0,4 m²
Gesucht: Druck p
Berechnung: 50000 : 0,4 = 125000 Pa = 1,25 bar
Beispielberechnung für Schweredruck in 50 m Tiefe unter Wasser:
Dichte (ϱ): 1000 kg/m³
Tiefe (h): 50 m
Fallbeschleunigung (g): 9,81 m/s²
Gesucht: Schweredruck p in 50 m Tiefe
Berechnung: 1000 · 9,81 · 50 = 490500 Pa = 4,905 bar
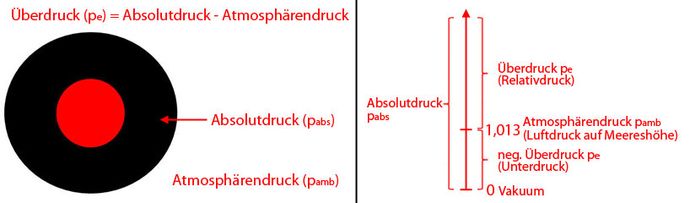
Druck in Relation zu Atmosphärendruck
Auf Meereshöhe herrscht ein Luftdruck (Atmosphärendruck, pamb) mit 1,013 bar. Pumpt man in dieser Umgebung z.B. einen Reifen auf, so gilt der gesamte Druck im Reifen als Absolutdruck (pabs). Die Differenz zwischen Atmosphärendruck und Absolutdruck wird Überdruck (pe) genannt. Der Überdruck kann auch negativ sein. Das ist dann der Fall, wenn der Druck im Reifen geringer ist als der Atmosphärendruck. Ein Vakuum entsteht, wenn man dem Reifen den gesamten Druck entzieht, so dass der Druck bei 0 bar liegt.
Die Formel zum Berechnen des Überdrucks pe ist:
- pe = pabs - pamb
Beispiel:
Absolutdruck (pabs): 3,5 bar
Atmosphärendruck (pamb): 1,013 bar
Gesucht: Überdruck pe
Berechnung: 3,5 - 1,013 = 2,487 bar
Auswirkung auf den Druck bei Volumen- und Temperaturänderung idealer Gase
Um das Verhalten eines Gases zu berechnen, z.B. bei Temperatur- oder Volumenänderung, verwendet man für das Gas häufig ein vereinfachtes Modell, das ideales Gas genannt wird. Dabei werden folgende Vereinfachungen angenommen:
- Die Glasteilchen werden als Massepunkte betrachtet, die sich nicht ausdehnen.
- Bei Stoßvorgängen haben die Glasteilchen nur ideal elastische Vorgänge.
- Die mittleren Abstände zwischen den Glasteilchen ist sehr viel größer als die Durchmesser der Glasteilchen.
Im Gegensatz zu Feststoffen und Flüssigkeiten gelten Gase als komprimierbar. Verringert sich z.B. das Volumen des Raumes, in dem sich das Gas befindet, verdichtet sich das Gas und der Druck nimmt zu. Bei einer Erhöhung der Temperatur steigt die Geschwindigkeit der Gasteilchen im Raum. Dadurch stoßen sie öfter an die Wände des Raumes und der Druck nimmt zu. Es kann natürlich auch der Fall eintreten, in dem die Temperatur steigt und gleichzeitig das Volumen geändert wird.
Aus diesen Zusammenhängen lassen sich die nachfolgenden Formeln ableiten, die für die konkrete Berechnung einer Größe umgestellt werden können. Als Temperatureinheit wird dabei Kelvin verwendet. 0° Celsius sind 273,15 Kelvin. Hat man es z.B. mit einer Temperatur von 15° Celsius zu tun, setzt man in Formeln als Temperatur 288,15 Kelvin ein (273,15 + 15).
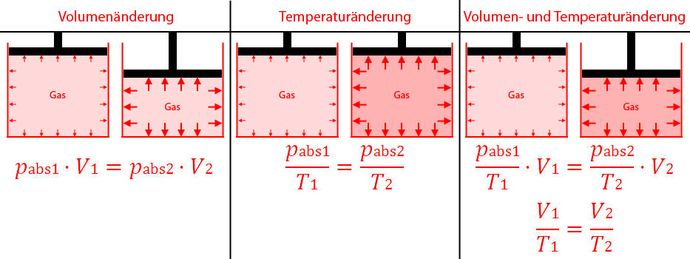
Beispiel:
50 m³ Luft wird auf 5 m³ verdichtet und gleichzeitig wird die Temperatur von 20° C auf 200° C erhöht. Gesucht wird der Druck pabs2.
Luftdruck (pabs1): 1,013 bar
Volumen 1 (V1): 50 m³
Volumen 2 (V2): 5 m³
Temperatur 1 (T1): 20° C = 293,15 Kelvin
Temperatur 2 (T2): 200° C = 473,15 Kelvin
Gesucht: Luftdruck pabs2
Formel umstellen auf: (pabs1 · V1 · T2) : (T1 · V2) = pabs2
Berechnung: (1,013 · 50 · 473,15) : (293,15 · 5) = 16,35 bar